Fuerzas de Vander Waals
La energía almacenada por estos enlaces, sumada a la red molecular de todo el conjunto de moléculas que forma la sustancia, determina la estabilidad de estos enlaces.
Piensa que si en varias moléculas, por ejemplo con enlaces covalente, no hubiera ninguna fuerza de unión entre ellas, estarían moviéndose libremente y por lo tanto siempre estarían en estado gaseoso (movimiento libre de las moléculas).
Ya sabemos que eso no es así, por que pueden estar también en estado sólido o líquido (no se mueven libremente), y esto quiere decir que habrá algún tipo de conexión-unión entre las moléculas. Ha este tipo de interacción o fuerza es lo que se conoce como fuerzas de interacción intermoleculares o de van der Waals.
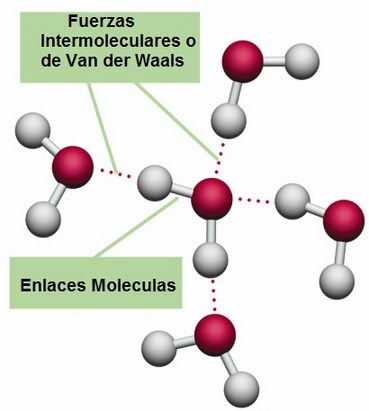
Las fuerzas de van der Waals son fuerzas de estabilización molecular (dan estabilidad a la unión entre varias moléculas), también conocidas como atracciones intermoleculares o de largo alcance y son las fuerzas entre moléculas (fuerzas entre molécula-molécula).
Son fuerzas mas débiles que las internas que unen la molécula ya que dependen exclusivamente del tamaño y forma de la molécula pudiendo ser de atracción o de repulsión. Son tan débiles que no se las puede considerar un enlace, como el enlace covalente o iónico, solo se las considera una atracción.
Para tener una idea de la poca fuerza que tienen, si un enlace covalente tuviera una fuerza de 100, las de Van der Waals serían de valor 1 (100 veces menor).
De hecho las fuerzas de van der Waals son las fuerzas atractivas o repulsivas entre moléculas (o entre partes de una misma molécula) distintas a aquellas debidas a un enlace (covalente, iónico o metálico). Incluyen a atracciones entre átomos, moléculas y superficies fuera de los enlaces normales.
Antes de explicar cada una de los tipos de fuerzas posibles de Van der Waals es importante conocer que hay moléculas polares y no polares.
Moléculas Polares y NO Polares
Moléculas Polares son aquellas cuyos enlaces son formados por átomos distintos con grandes diferencias de electronegatividad, formando moléculas polares.
La molécula es eléctrica mente neutra en su conjunto por tener igual de partículas positivas y negativas, pero no existe simetría en la distribución de la electricidad. La distribución de las cargas eléctricas no es simétrica respecto a un centro.
Comentario: las fuerzas de vander waals son fuerzas de atraccion o repulsion electrostaticas entre moleculas o entre partes de una misma moleculas,
Las fuerzas electrostaticas se establecen entre iones de distinta o igual carga
los iones con cargas opuestas (+) (-) se atraen
los iones con cargas iguales(+)(+) se repelen entre si.
creo que son casi lo mismo
Referencia: https://www.ecured.cu/Fuerzas_de_Van_der_Waals
No hay comentarios.:
Publicar un comentario